化学学院吕华课题组开发GalNAc官能化聚二硫化物偶联物实现肝靶向的生物大分子胞内递送
2024/02/21 信息来源: 化学与分子工程学院
文字:牛林| 编辑:山石 | 责编:安宁近日,北京大学化学与分子工程学院吕华教授课题组在《美国化学会志》(J. Am. Chem. Soc.)上发表题为“Organ/Cell-Selective Intracellular Delivery of Biologics via N-Acetylated Galactosamine-Functionalized Polydisulfide Conjugates”(DOI:10.1021/jacs.3c11914)的研究论文。在这项工作中,作者开发了一种N-乙酰化半乳糖胺(GalNAc)功能化的聚二硫化物(PDS)与生物大分子的偶联物,成功将生物大分子靶向递送至肝细胞,为一系列肝脏靶向疾病的诊断和治疗开辟了新的途径。
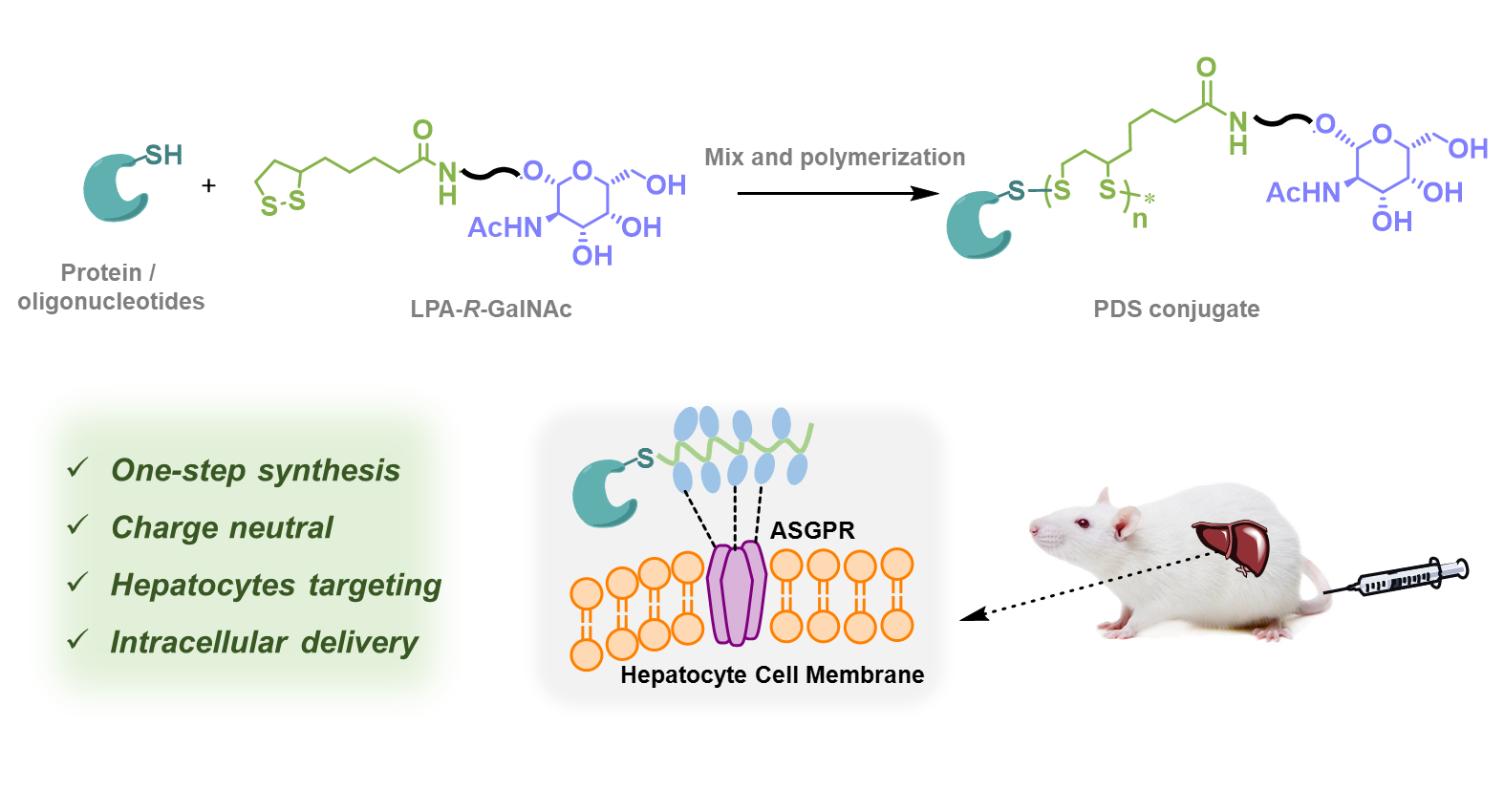
图1. 本文工作示意图
近年来,生物大分子药物因其高效性和特异性得到了迅速的发展,然而通过全身给药实现对特定器官的选择性细胞内递送仍然是临床应用中的一大障碍。针对这一点,科学家开发了一系列生物大分子的细胞内递送系统,包括脂质纳米颗粒、高分子或金属-有机框架等递送载体,然而这些载体通常带正电荷,具有一定的细胞毒性;此外,药物的提前释放以及内涵体逃逸效率低下等问题也会降低治疗效果。因此亟需开发一类结构成分简单且高效的电中性递送系统来应对生物大分子递送中的多种挑战。
在前期工作中,吕华课题组开发了冷冻聚合及聚集诱导聚合(AIP)等蛋白质原位引发的偶联方法,实现了低浓度下1,2-二硫戊环单体的开环聚合(Lu, J.H. et al. J. Am. Chem. Soc. 2020, 142, 1217—1221;J. Am. Chem. Soc. 2022, 144, 15709—15717)。在该文中,作者以巯基修饰的蛋白质或反义寡核苷(ASO)为引发剂,通过AIP方法引发GalNAc官能化的硫辛酸衍生物单体的聚合,简便地制备了相应的偶联物,其具有较窄的分散度。
随后,作者证明了GalNAc官能化的蛋白-PDS偶联物具有肝细胞靶向的递送能力(图2)。通过一系列竞争性实验,作者提出其可能的细胞递送机制:偶联物首先通过PDS侧链的多价GalNAc与肝细胞表面受体ASGPR识别,锚定在肝细胞膜表面;随后通过PDS介导的巯基-双硫键交换反应跨过细胞膜进入胞内;在胞内的PDS接着被高浓度的GSH降解并进而释放蛋白。这种机制强调了第一步的GalNAc-ASGPR识别和细胞膜锚定对于PDS发挥后续跨膜作用的重要性。作者进一步优化了连接子、聚合物长度、GalNAc比例、孵育浓度以及内吞时间等参数以提高偶联物的递送效率。作者将该方法应用制备了ASO-PDS偶联物,并将其递送进肝细胞,western blot实验表明靶基因的蛋白水平被成功敲低。
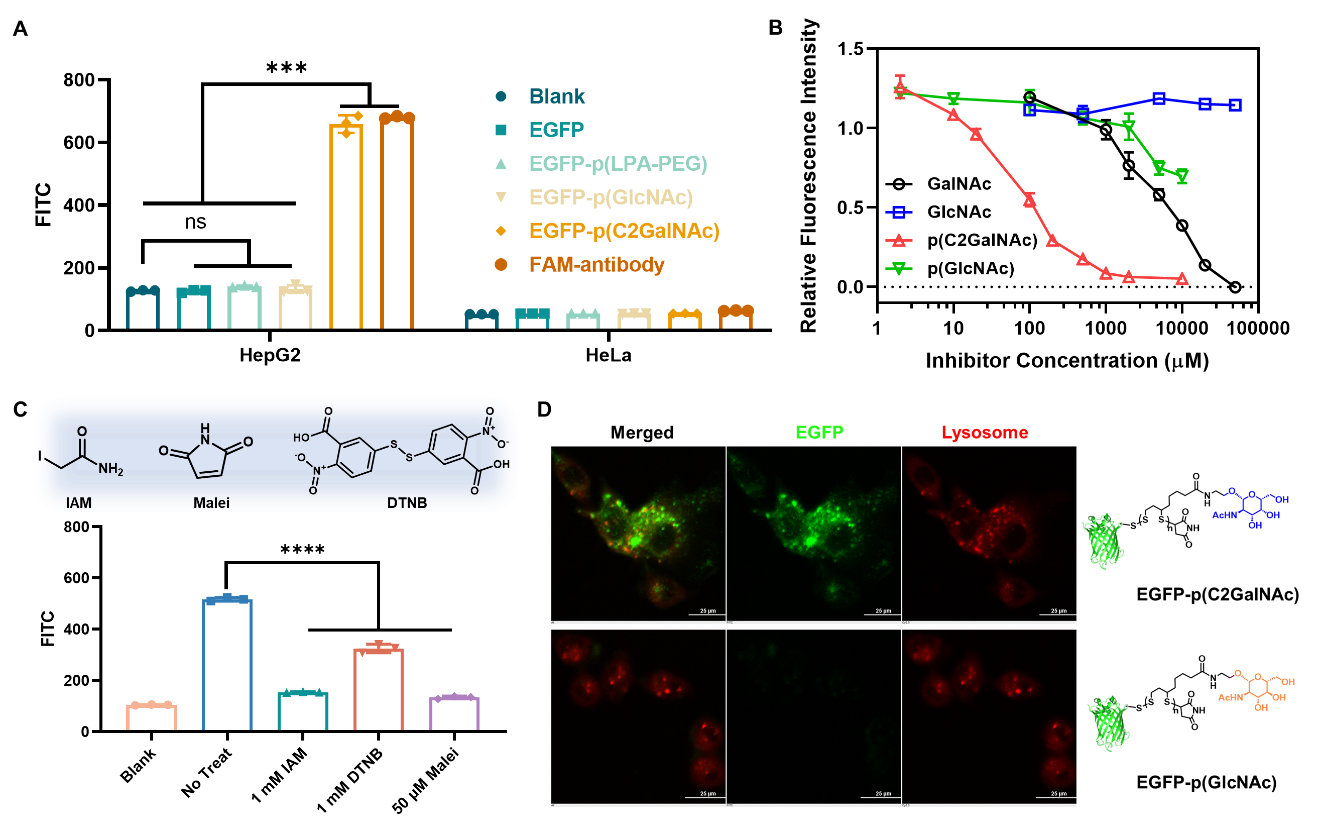
图2. GalNAc功能化的聚二硫化物偶联物的体外肝细胞选择性递送
作者进一步将GalNAc功能化的蛋白-PDS偶联物注射入小鼠体内,荧光成像实验表明该偶联物会迅速在肝脏中积累,在2.5h后达到峰值(图3),证明了这种偶联物的活体肝脏靶向能力。
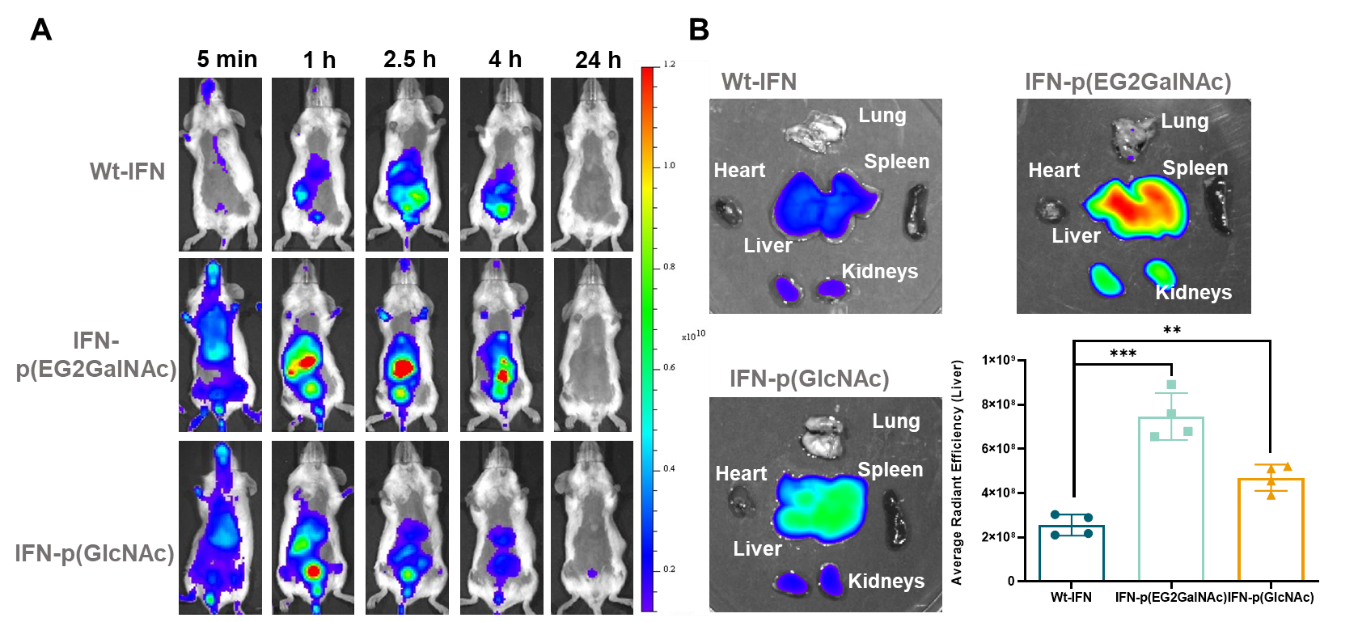
图3. GalNAc功能化的聚二硫化物偶联物的体内肝靶向递送
总结而言,该项工作用简单的合成方法发展了一类电中性的靶向递送生物大分子体系。论文第一作者为课题组2023届博士毕业生鹿建华博士,通讯作者为吕华。该工作受到了来自国家重点研发计划、国家自然科学基金、北京市自然科学基金等项目经费的支持。课题开展过程中北京大学医学部陈香梅教授和姜长涛教授提供了科学指导和实验帮助。
转载本网文章请注明出处